产品应用/ Apply
公司证书/ Certi
行业新闻
当前位置:首页 -> 行业新闻最新!2022年FDA医疗器械评审收费标准!看看哪些企业将获得减免优……
作者: 发布时间:2021/8/7 15:23:53 浏览次数:2670
工欲善其事,必先利其器。医疗器械作为现代医疗的重要工具,在疾病的预防、诊断与治疗中发挥着极其重要的作用,更是与人类生命健康息息相关的产品,是我国医疗卫生体系建设中的基础装备,其战略地位受到世界各国的高度重视。
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只是起辅助作用。
近年来随着我国经济发展“供给侧改革”战略的实施,将医疗器械产业的发展列入了国家发展战略中,医疗器械行业进入高速发展期,逐渐跻身国际医疗器械行业,从消费大国逐渐转化为制造大国和出口大国。

随着美国公众健康意识增强,医疗服务机构对高品质医疗器械的要求不断提高,美国政府为提升医疗器械的安全性制定了相应的法律法规,以保护民众的生命安全。
因此我国医疗器械行业在走出国门时有必要对相关国家的法律法规有所了解,并知晓相应的监管要求和市场需求的方向,针对性地采取相应的策略和措施,稳步推进,不断提高产品的能级,逐步扩大海外市场。本期小编整理了中国出口美国地区医疗器械的准入要求,仅供大家参考。
美国FDA
美国食品药品监督管理局(简称:FDA),其职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品等的安全,同时也负责执行公共卫生条件及州际旅行和运输的检查、对于诸多产品中可能存在的疾病的控制等。
医疗器械分类
医疗器械范围很广,小到医用手套,大至心脏起博器,均在FDA监督之下,根据医疗用途和对人体可能的伤害,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,等级越高监督越严。
第一类(低至中度风险):普通管理。是指风险小或无风险的产品。
第二类(中度至高度风险):普通+特殊管理。其管理是在“普通管理”的基础上,还要通过实施标准管理或特殊管理,以保证质量和安全有效性。
第三类(高风险):上市前批准管理(PMA)。是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。
准入要求
对Ⅰ类产品,企业向FDA递交相关资料并审核通过后,FDA只进行公告,但并无相关证件发给企业;
对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。

最新FDA收费标准
2021年8月2日,美国FDA关于2022年的收费标准已正式公布。其中FDA企业注册和器械列名的年费和510(K) 申报费用对中国的制造商影响比较大,这两项费用都略有提高。
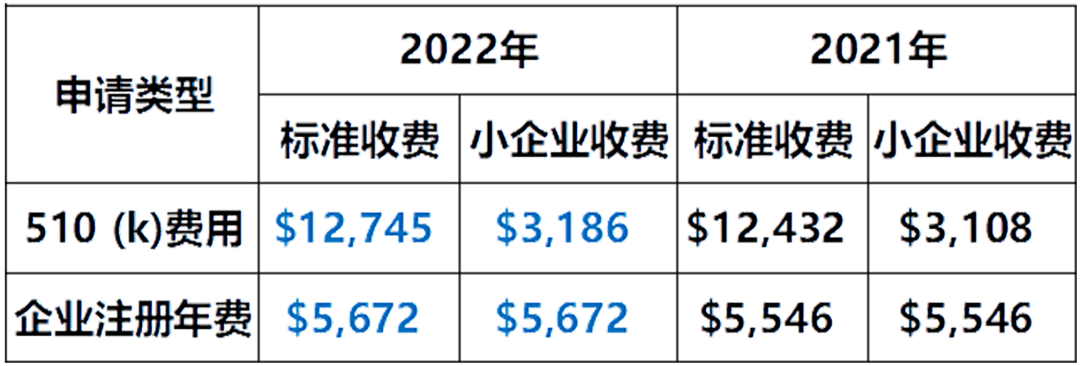 FDA其他相关项目收费情况如下
FDA其他相关项目收费情况如下
哪些企业将获得减免优惠
一、小企业申请条件
如果您的企业(包括您的附属公司)在最近一个纳税年度的总收入或销售额不超过 1 亿美元,您可能有资格申请获得小企业收费减免。
如果想要享受小企业费用的减免,需要向FDA提交税务证明批准小企业资质,通常在FDA收到资料的60天内做出决定。需要注意的是,年度场地注册费没有小企业减免政策。
二、小企业申请所需材料
如果您是美国本土企业并希望在 2022 财年符合小型企业的资格,请向 FDA 提交以下内容:
一份完整的 MDUFA 小型企业认证申请,适用于美国境内的企业(表格 FDA 3602)。
最近一个纳税年度的联邦(美国)所得税申报表的签名副本。
如果企业拥有附属公司,您需要:
如果附属公司是美国本土企业,则需提交该附属公司最近一个纳税年度的联邦(美国)所得税申报表的签名副本。
如果附属公司是非美国本土且无法提交联邦(美国)所得税申报表,则由公司总部所在国的国家税务局完成并盖有公章的国家税务局证明。
如果您是非美国本土企业,并希望在 2022 财年有资格成为小型企业,请提交以下内容:
一份完整的 MDUFA 外国小企业认证申请表格(表格 FDA 3602A),该申请表单适用于位于美国境外的企业。
国家税务机关证明,由公司总部所在国国家税务机关填写并加盖公章。该证明必须显示最近一个纳税年度的总收入或销售额。
如果企业拥有附属公司,您需要:
如果附属公司是美国本土企业,则附属公司最近一个纳税年度(2021 年或之后)的联邦(美国)所得税申报表的签名副本。
如果附属公司是非美国本土企业且无法提交联邦(美国)所得税申报表,则由公司总部所在国的国家税务局完成并盖有公章的国家税务局证明。
重要提醒:
1)每年10月1日到12月31日期间,需要更新FDA注册以确保下一年持续处于有效状态;
2)510(K)的小企业资质申请结果,不能跨越财政年度使用。请基于贵司的510(K)申报进度计划妥善安排申报小企业资质的时间。

【免责声明:本文内容及图片来源公开网络由质惠全球整理转载,转载文章请注明出处,如涉及版权问题,请留言与我们联系,我们将在第一时间删除】
文章标题:最新!2022年FDA医疗器械评审收费标准!看看哪些企业将获得减免优……
本文地址:http://www.dggso.com/news/820.html
本文来源:广东光塑科技股份有限公司
版权所有 ©2013 广东光塑科技股份有限公司 粤ICP备13074258号-1 Link:www.dggso.com 由驿铭网络提供网络技术支持
地址:广东省江门市蓬江区江杜西路245号6栋厂房 电话:0750-3678112 传真:0750-3687112 全国统一客服热线:400-8080-850





